FDA điều tra hai tác dụng phụ liên quan đến glutamine, arginine và sản phẩm carnitine kết hợp của United Pharmacy để tiêm
Phân tích trong phòng thí nghiệm của FDA cho thấy glutamine trong sản phẩm hỗn hợp glutamine, arginine và carnitine (GAC) 10/100/200 mg / mL của United Pharmacy để tiêm bị phân hủy trước ngày quá hạn sử dụng (BUD) 6 tháng được ghi trên nhãn sản phẩm.
Trước đây, FDA đã báo cáo rằng sản phẩm được dán nhãn bao gồm 10 mg / mL glutamine, nhưng không tìm thấy glutamine trong các mẫu từ các lô GAC-12 hoặc GAC-13 được kiểm tra trong thời hạn sử dụng. Kể từ thời điểm đó, FDA đã kiểm tra hai mẫu có sẵn của thành phần dược phẩm hoạt tính glutamine (API) được thu thập từ nhà cung cấp API được United Pharmacy sử dụng và xác định độ tinh khiết trung bình của các mẫu nằm trong phạm vi chấp nhận được là 98,1% và 98,6% so với nhãn của nó. yêu cầu. FDA cũng kiểm tra thêm các mẫu GAC-12 và GAC-13 của United Pharmacy để xác định xem glutamine có bị phân hủy hay không.
Glutamine được biết là phân hủy thành amoniac và axit pyroglutamic trong dung dịch nước 3. Phân tích trong phòng thí nghiệm của FDA đã phát hiện ra sự hiện diện của axit pyroglutamic trong các mẫu với lượng gần tương đương với sự phân hủy của khoảng 10 mg / mL glutamine. Cụ thể, phân tích trong phòng thí nghiệm của FDA cho thấy mẫu từ lô GAC-12 đã hết hạn tại thời điểm thử nghiệm chứa 9,28 mg / mL axit pyroglutamic, đây là sản phẩm phân hủy dự kiến và có nồng độ từ 10,51 mg / mL dung dịch nước glutamine. Mẫu từ lô GAC-13 đã hết hạn sử dụng chứa 8,91 mg / mL axit pyroglutamic, đây sẽ là sản phẩm phân hủy dự kiến và có nồng độ từ 10,09 mg / mL dung dịch nước glutamine. Những dữ liệu này cho thấy rằng công thức glutamine này không ổn định về mặt hóa học trước khi đến ngày hết hạn.
United Pharmacy đã thu hồi tất cả GAC 10/100/200 mg / mL cho các sản phẩm tiêm và ngừng sản xuất công thức này.
FDA khuyến khích các nhà sản xuất hợp chất thực hiện các nghiên cứu về độ ổn định đối với các dung dịch có chứa glutamine để xác nhận rằng glutamine không bị phân hủy trước BUD quy định của sản phẩm.
Ngày 8 tháng 11 năm 2017
Bản tóm tắt
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã nhận được một báo cáo về sự kiện bất lợi cho biết rằng hai bệnh nhân đã phát triển những gì được mô tả trong báo cáo là xói mòn mô tại vị trí tiêm sau khi sử dụng sản phẩm tiêm glutamine, arginine và carnitine (GAC) được kết hợp bởi United Pharmacy, LLC, nằm ở West Palm Beach, Florida. Theo báo cáo, một mẫu sản phẩm đã được gửi đi xét nghiệm và độ pH được xác định là trên 11. FDA đã tiến hành kiểm tra nguyên nhân đối với United Pharmacy và thu thập mẫu từ hai lô sản phẩm thuốc tiêm GAC. Phân tích được thực hiện trên các mẫu đã xác định độ pH là 10,9, có tính kiềm và không phát hiện thấy glutamine. Thuốc tiêm, bao gồm cả thuốc tiêm phối hợp, có độ pH cao có thể dẫn đến tổn thương da hoặc các hậu quả sức khỏe không mong muốn khác.1
Các biến cố bất lợi
Vào ngày 21 tháng 4 năm 2017, FDA đã biết về các tác dụng phụ ở hai bệnh nhân. Cả hai bệnh nhân đều trải qua những gì được mô tả trong báo cáo là xói mòn mô tại vị trí tiêm sau khi sử dụng GAC (xem Hình 1). Báo cáo cho biết sản phẩm thuốc tiêm GAC được kết hợp bởi United Pharmacy. Theo báo cáo, một lọ sản phẩm đã được gửi đi xét nghiệm và độ pH được xác định là trên 11.
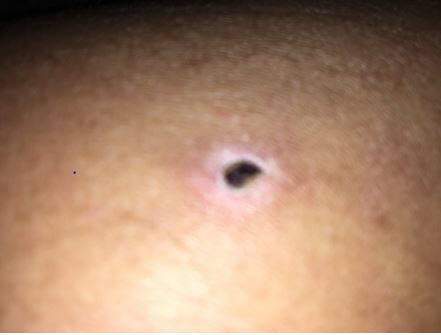
sự xói mòn mô tại vị trí tiêm sau khi
tiêm GAC.
Điều tra và Phát hiện của FDA
FDA đã tiến hành một cuộc thanh tra nguyên nhân đối với United Pharmacy để phản hồi các tác dụng phụ được báo cáo. Trong quá trình kiểm tra, FDA đã thu thập và phân tích các mẫu sản phẩm thuốc tiêm GAC từ hai lô có sẵn: GAC-12 và GAC-13. Nhãn của một trong những mẫu đó ghi: “Tiêm dưới da 1 mL vào ống tiêm insulin cách ngày vào buổi sáng.” FDA nhận thấy các mẫu có độ pH là 10,9. Ngoài ra, bảng công thức của United Pharmacy dành cho các sản phẩm thuốc tiêm GAC có tiêu chí chấp nhận cho độ pH từ axit (pH: 2) đến cơ bản
(pH: 11).
Hơn nữa, FDA nhận thấy các mẫu không chứa bất kỳ lượng glutamine nào. Nhãn của các mẫu thuốc tiêm GAC chỉ ra rằng 10 mg / mL glutamine, 100 mg / mL arginine và 200 mg / mL carnitine được chứa trong lọ 30 mL.
United Pharmacy thu hồi lô GAC-12 và GAC-13 vào ngày 27/09/2017.
Thảo luận
Theo Broadhead và Gibson, các sản phẩm tiêm được pha chế với độ pH gần với pH sinh lý, hoặc khoảng pH 7,4, có thể giảm thiểu đau, kích ứng và tổn thương mô. 1 Broadhead và Gibson lưu ý rằng hầu hết các sản phẩm tiêm được chấp thuận có độ pH trong khoảng từ 3 đến 9 và phạm vi được khuyến nghị cho các sản phẩm tiêm dưới da dành cho tiêm dưới da là 3 đến 6. 1 Họ cũng lưu ý rằng độ pH lớn hơn 9 có thể gây ra hoại tử mô. 1 Ngoài ra, Roethlisberger và cộng sự báo cáo rằng tổn thương da tại vị trí tiêm sau khi tiêm dưới da có thể do căng thẳng vật lý (ví dụ: áp suất thẩm thấu) và căng thẳng hóa học ngoài độ pH (ví dụ: hàm lượng dung môi). 2 Không rõ liệu những yếu tố khác này có thể góp phần vào những gì được mô tả trong báo cáo là xói mòn mô tại chỗ tiêm hay không.
Tóm tắt rủi ro
Thuốc kết hợp chưa được FDA đánh giá về độ an toàn, hiệu quả và chất lượng. Không có sản phẩm GAC tiêm nào được FDA chấp thuận. Khi FDA xem xét đơn đăng ký cho một loại thuốc tiêm, tính an toàn tổng thể của sản phẩm sẽ được đánh giá, bao gồm, nếu có liên quan ở đây, tính phù hợp của độ pH và việc ghi nhãn của sản phẩm.
Cuộc điều tra của FDA về các tác dụng ngoại ý liên quan đến sản phẩm GAC của United Pharmacy để tiêm làm nổi bật một số rủi ro liên quan đến các loại thuốc kết hợp không được FDA đánh giá sơ bộ. Các rủi ro được minh họa trong trường hợp này bao gồm:
- các thông số kỹ thuật của sản phẩm được sử dụng bởi các cơ sở sản xuất hỗn hợp, chẳng hạn như độ pH, và độ pH của thuốc hỗn hợp không được FDA đánh giá về độ an toàn;
- việc sử dụng dưới da một sản phẩm tiêm có độ pH kiềm có thể dẫn đến tổn thương da hoặc các hậu quả sức khỏe không mong muốn khác; và
- các thành phần được liệt kê trên nhãn của một sản phẩm hỗn hợp có thể không phản ánh chính xác các thành phần có trong sản phẩm.
Các hiệu thuốc tổng hợp nên biết thông tin an toàn liên quan đến các thuộc tính vật lý và hóa học của các sản phẩm tiêm của họ, bao gồm cả độ pH. Vì các sản phẩm hỗn hợp không được FDA đánh giá về độ an toàn và hiệu quả, các chuyên gia chăm sóc sức khỏe nên truy vấn nhà thuốc về hỗn hợp về thông tin an toàn liên quan đến các thuộc tính vật lý và hóa học của sản phẩm hỗn hợp mà họ định tiêm cho bệnh nhân.
FDA khuyến khích người tiêu dùng, bệnh nhân và các chuyên gia chăm sóc sức khỏe báo cáo các sự kiện bất lợi hoặc các vấn đề chất lượng gặp phải khi sử dụng các sản phẩm thuốc kết hợp cho chương trình Báo cáo Sự kiện Có hại MedWatch của FDA :
- Hoàn thành và gửi báo cáo trực tuyến tại www.fda.gov/medwatch/report.htm ; hoặc là
- Tải xuống và hoàn thành biểu mẫu , sau đó gửi qua fax theo số 1-800-FDA-0178.
Người giới thiệu
[1] Broadhead, J và Gibson M. 2009. Dạng Liều lượng Đường tiêm. Ở Gibson, M. ed. Sơ chế và bào chế dược phẩm: Hướng dẫn thực hành từ việc lựa chọn thuốc cho ứng viên đến dạng bào chế thương mại . Boca Raton, FL: CRC Press LLC; tr.326-327.
[2] Roethlisberger D, Mahler HC, Altenburger U và Pappenberger A. Nếu Euhydric và Isotonic không có tác dụng, thì pH và độ thẩm thấu có thể chấp nhận được đối với Dạng dùng thuốc qua đường tiêm là gì? J Pharm Sci . 2017; 106: 446-456.
[3] Khan K, Elia M. Các yếu tố ảnh hưởng đến độ ổn định của L-glutamine trong dung dịch. Clin Nutr 1991; 10 (4): 186-192.
Comments
Post a Comment