Sự khác biệt về biểu hiện sức mạnh trên nhãn sản phẩm của nhà sản xuất hỗn hợp và nhà sản xuất thông thường có thể dẫn đến sai số khi dùng
Bản tóm tắt
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã nhận được báo cáo về sai sót trong liều lượng và nhầm lẫn với biểu hiện sức mạnh được dán nhãn cho một số sản phẩm tiêm hỗn hợp. Các nhà sản xuất thông thường ghi nhãn sản phẩm tiêm của họ với cường độ trên tổng thể tích là biểu hiện chính và nổi bật về độ mạnh trên nhãn, trong khi một số nhà sản xuất hợp chất lại dán nhãn sản phẩm tiêm của họ theo cách khác. Dưới đây là mô tả các trường hợp báo cáo mà FDA nhận được. Các báo cáo trường hợp minh họa sự khác biệt trong nhãn sản phẩm của các nhà sản xuất thông thường và các nhà sản xuất hỗn hợp có thể dẫn đến sai số về liều lượng.
Báo cáo trường hợp
FDA đã nhận được hai báo cáo của MedWatch liên quan đến lỗi thuốc liên quan đến việc sử dụng quá liều các sản phẩm tiêm hỗn hợp. Trong báo cáo đầu tiên, một bệnh nhân được kê đơn 50 mcg fentanyl. Sản phẩm được sử dụng cho bệnh nhân được kết hợp bởi một địa điểm cơ sở không được tiết lộ thuộc sở hữu của Dịch vụ Dược phẩm Trung ương. Theo báo cáo, túi fentanyl IV được dán nhãn độ mạnh trên mililit (50 mcg / mL) ở phông chữ lớn và độ mạnh trên tổng thể tích (2.500 mcg / 50 mL) ở dưới bằng phông chữ nhỏ hơn. Bệnh nhân vô tình được sử dụng 2.500 mcg fentanyl (tương đương với 50 lần liều lượng quy định của họ). Báo cáo lưu ý rằng nguyên nhân của lỗi được cho là do cường độ 50 mcg / mL được nêu rõ ràng, bị hiểu nhầm là tổng lượng fentanyl trong túi.
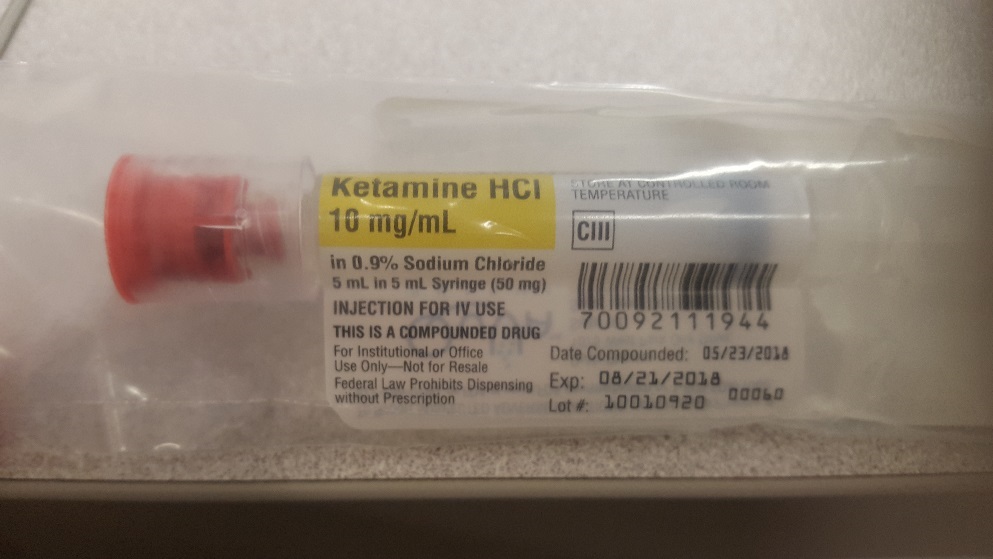
Trong báo cáo thứ hai, một bệnh nhân được kê đơn từ 5 đến 10 mg ketamine khi cần thiết để giảm đau. Thuốc tiêm ketamine được thực hiện cho bệnh nhân do QuVa Pharma, Inc., có trụ sở tại Sugar Land, Texas. Theo báo cáo, sản phẩm được dán nhãn là Ketamine HCl 10mg / mL được đánh dấu bằng màu vàng Bệnh nhân vô tình nhận được 50 mg ketamine (tương đương với 5 đến 10 lần liều lượng quy định của họ) và trở nên buồn ngủ (buồn ngủ bất thường). Báo cáo lưu ý rằng nguyên nhân của lỗi được cho là do nồng độ 10 mg / mL được nêu rõ ràng, bị hiểu nhầm là tổng lượng ketamine trong ống tiêm.
Hình 1. Hình ảnh nhãn cho ống tiêm Ketamine HCl 10 mg / mL do QuVa Pharma sản xuất. Sản phẩm được dán nhãn với cường độ trên mỗi mililit được đánh dấu bằng màu vàng Độ mạnh trên tổng thể tích trong ống tiêm được in bên dưới văn bản được đánh dấu bằng phông chữ nhỏ hơn.
Ngoài ra, FDA đã nhận được nhiều đơn khiếu nại làm dấy lên lo ngại rằng việc hiển thị cường độ trên mililit bằng phông chữ lớn hơn, nổi bật hơn, thay vì cường độ trên tổng thể tích, có thể dẫn đến nhầm lẫn về lượng thuốc trong hộp. Một khiếu nại như vậy liên quan đến ống tiêm phenylephrine 200 mcg / 5 mL, được chế tạo bởi New England Lifecare Inc. dba Advanced Compound Solutions, có trụ sở tại Woburn, Massachusetts. Theo báo cáo, sản phẩm được dán nhãn cường độ trên mililit (40 mcg trên mL) ở phông chữ lớn và cường độ trên tổng thể tích (200 mcg trên 5 mL) bên dưới bằng phông chữ nhỏ hơn.
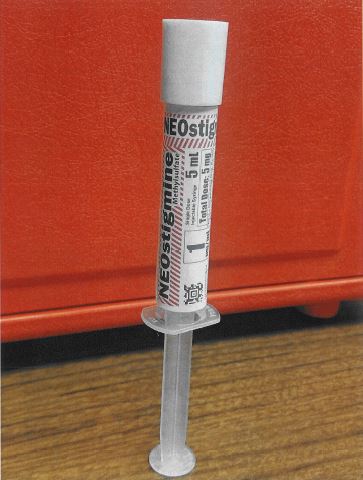
Một báo cáo khác đã nhận được mô tả những phàn nàn tương tự về việc ghi nhãn ống tiêm neostigmine 1 mg / mL và ống tiêm succinylcholine 20 mg / mL do KRS Global Biotechnology, Inc., đặt tại Boca Raton, Florida, tổng hợp. Cường độ trên tổng thể tích không phải là biểu hiện nổi bật nhất của cường độ trên nhãn của ống tiêm (xem Hình 2 và Hình 3).
Hình 2. Hình ảnh nhãn cho ống tiêm neostigmine 1 mg / mL được kết hợp bởi KRS Global Biotechnology. Cường độ trên mỗi mililit được hiển thị trong một hộp, tổng liều trong một hộp liền kề và tổng thể tích trong ống tiêm phía trên hộp chứa tổng liều.
Hình 3. Hình ảnh nhãn cho ống tiêm succinylcholine 20 mg / mL được kết hợp bởi KRS Global Biotechnology. Cường độ trên mỗi mililit được hiển thị trong một hộp, tổng liều trong một hộp liền kề và tổng thể tích trong ống tiêm phía trên hộp chứa tổng liều.
Một báo cáo bổ sung đã nhận được mô tả sự nhầm lẫn nhãn với một túi IV chứa 4 mg norepinephrine bitartrate được thêm vào 250 mL thuốc tiêm dextrose 5% (16 mcg mỗi mL) do PharMEDium Services, LLC, đặt tại Sugar Land, Texas (xem Hình 4 ). Như được mô tả trong báo cáo này, bơm IV đã được lập trình không chính xác với nồng độ 16 mg / mL khi nồng độ được đặt hàng là 4 mg / 250 mL. Như được mô tả trong báo cáo, nhãn sản phẩm có thể dẫn đến nhầm lẫn vì nồng độ trên mỗi mililit là 16 mcg trên mL bị hiểu sai thành 16 mg / 250 mL.
Hình 4. Hình ảnh nhãn cho 4 mg norepinephrine bitartrate được thêm vào 250 mL thuốc tiêm Dextrose 5% USP (16 mcg mỗi mL) do PharMEDium Services kết hợp.
Thảo luận
FDA đã ban hành dự thảo hướng dẫn vào tháng 4 năm 2013 với tiêu đề “ Cân nhắc An toàn đối với Nhãn Container và Thiết kế Ghi nhãn Carton để Giảm thiểu Sai sót về Thuốc ”, áp dụng cho các loại thuốc kê đơn được bán trên thị trường và các sản phẩm sinh học do CDER quản lý. Bản dự thảo hướng dẫn này khuyến nghị rằng “[f] hoặc các sản phẩm dùng đường tiêm thể tích nhỏ, cường độ trên tổng thể tích phải là biểu thức chính và nổi bật trên bảng hiển thị chính của nhãn, theo sau là cường độ trên mỗi mililit kèm theo dấu ngoặc đơn.” 1FDA tin rằng các biện pháp như vậy, nếu được thông qua, sẽ giúp tránh hoặc giảm thiểu các sai sót về liều lượng thường được báo cáo. Những khuyến nghị này đã được đề xuất để giải quyết tình trạng quá liều xảy ra "do bác sĩ chăm sóc sức khỏe và bệnh nhân không xác định được tổng lượng thuốc trong hộp đựng." 1 Hướng dẫn dự thảo của FDA nhất quán với các yêu cầu ghi nhãn theo yêu cầu của Dược điển Hoa Kỳ (USP) trong Chương 7 chung (USP <7>) về Ghi nhãn. 2
Viện Thực hành Thuốc An toàn (ISMP) đã ban hành các cảnh báo về an toàn thuốc liên quan đến chủ đề này. 3 , 4 Trong một bản tin phát hành ngày 22 tháng 3 năm 2018, ISMP tuyên bố rằng họ đã “quan sát thấy rằng cường độ trên mỗi mL thường được sử dụng làm biểu hiện chính trên nhãn của các hợp chất, dẫn đến sự không nhất quán giữa các sản phẩm có sẵn trong bệnh viện, do đó tạo ra sự không an toàn các điều kiện. Sai sót đã xảy ra khi cường độ trên mỗi mL nổi bật hơn bị nhầm lẫn với tổng lượng thuốc trong ống tiêm. Những lỗi như vậy là động lực cho yêu cầu USP <7> về sự nổi bật của cường độ trên tổng khối lượng trên nhãn. ” 3 , 4
Tóm tắt rủi ro
Thuốc kết hợp không được FDA đánh giá về độ an toàn, hiệu quả và chất lượng. Khi FDA xem xét đơn đăng ký một loại thuốc tiêm, mức độ an toàn tổng thể của sản phẩm sẽ được đánh giá, bao gồm cả nhãn của sản phẩm, như có liên quan ở đây. Như các báo cáo trường hợp này minh họa, có sự khác biệt trong thực hành ghi nhãn giữa các nhà sản xuất thông thường và các nhà sản xuất hỗn hợp trong việc hiển thị sức mạnh của họ trên nhãn sản phẩm. Điều này có thể dẫn đến sai số về liều lượng khi các chuyên gia chăm sóc sức khỏe, những người quen thuộc hơn với cách diễn đạt thông thường về thông tin sức mạnh, đang sử dụng các loại thuốc kết hợp. Có thể tránh được các loại lỗi định lượng này đối với các sản phẩm dùng đường tiêm thể tích nhỏ, bằng cách biểu thị nồng độ thuốc trên tổng thể tích dưới dạng biểu hiện chính và nổi bật trên bảng hiển thị chính của nhãn,
Việc ghi nhãn thuốc tiêm hỗn hợp bằng cách sử dụng quy ước về độ bền được các nhà sản xuất thông thường áp dụng có thể tránh nhầm lẫn và giảm nguy cơ sai sót thuốc. Bởi vì nhãn của các sản phẩm hỗn hợp không được FDA xem xét trước khi tiếp thị, các chuyên gia chăm sóc sức khỏe nên thận trọng khi sử dụng các sản phẩm hỗn hợp cho bệnh nhân để tránh nhầm lẫn và đảm bảo rằng mỗi bệnh nhân được sử dụng đúng liều lượng quy định của loại thuốc dự định. Các chuyên gia chăm sóc sức khỏe có thể cân nhắc việc yêu cầu các nhà sản xuất ghi nhãn sản phẩm với cường độ tính trên tổng thể tích là biểu hiện chính và nổi bật trên bảng hiển thị chính của nhãn, tiếp theo là độ mạnh trên mỗi mililit kèm theo dấu ngoặc đơn để giảm thiểu nguy cơ sai sót.
Thông tin Báo cáo MedWatch
FDA khuyến khích người tiêu dùng, bệnh nhân và các chuyên gia chăm sóc sức khỏe báo cáo lỗi thuốc, các tác dụng ngoại ý và các vấn đề chất lượng gặp phải khi sử dụng các sản phẩm thuốc kết hợp cho chương trình Báo cáo Sự kiện Có hại MedWatch của FDA :
- Hoàn thành và gửi báo cáo trực tuyến tại www.fda.gov/medwatch/report.htm ; hoặc là
- Tải xuống và hoàn thành biểu mẫu , sau đó gửi qua fax theo số 1-800-FDA-0178.
Người giới thiệu
- Cục Quản lý Thực phẩm và Dược phẩm (tháng 4 năm 2013). Cân nhắc An toàn đối với Nhãn Thùng và Thiết kế Nhãn Thùng để Giảm thiểu Lỗi Thuốc. Bản thảo Hướng dẫn.
- Dược điển Hoa Kỳ. Chương chung <7> Ghi nhãn.
- Viện Thực hành Thuốc An toàn. Cảnh báo! Biểu hiện sức mạnh không nhất quán trên ống tiêm thuốc mê thuê ngoài. Cảnh báo An toàn Thuốc! Chăm sóc cấp tính. Năm 2017; 22 (6).
- Viện Thực hành Thuốc An toàn. Cần có Hướng dẫn của FDA để Đảm bảo Thực hành Ghi nhãn An toàn bởi các Hợp chất 503A và 503B. Cảnh báo An toàn Thuốc! Chăm sóc cấp tính. Năm 2018; 23 (6)


Comments
Post a Comment