Truyền thông về An toàn Thuốc của FDA: FDA báo cáo những thay đổi màu da vĩnh viễn liên quan đến việc sử dụng miếng dán Daytrana (hệ thống thẩm thấu qua da methylphenidate) để điều trị ADHD
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) cảnh báo rằng tình trạng mất màu da vĩnh viễn có thể xảy ra khi sử dụng miếng dán Daytrana (hệ thống thẩm thấu qua da methylphenidate) cho chứng Rối loạn tăng động giảm chú ý (ADHD). FDA đã thêm một cảnh báo mới vào nhãn thuốc để mô tả tình trạng da này, được gọi là bệnh bạch cầu hóa học.
Bệnh nhân hoặc người chăm sóc của họ nên theo dõi các vùng da mới sáng hơn, đặc biệt là dưới miếng dán thuốc và báo cáo ngay những thay đổi này cho các chuyên gia chăm sóc sức khỏe của họ. Bệnh nhân không nên ngừng sử dụng miếng dán Daytrana mà không nói chuyện trước với các chuyên gia chăm sóc sức khỏe của họ. Chúng tôi khuyến nghị các chuyên gia chăm sóc sức khỏe xem xét các phương pháp điều trị thay thế cho những bệnh nhân gặp phải những thay đổi màu da này.
Miếng dán Daytrana điều trị ADHD bằng cách làm tăng sự chú ý và giảm sự bồn chồn ở trẻ em và thanh thiếu niên hoạt động quá mức, không thể tập trung trong thời gian dài hoặc dễ bị phân tâm và bốc đồng.
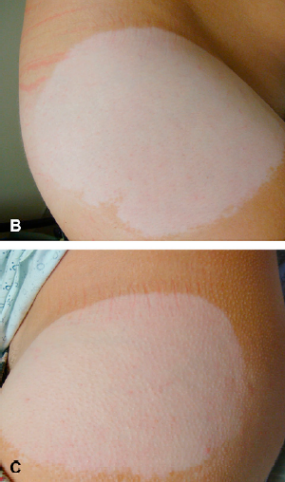
Bệnh bạch cầu hóa học là một tình trạng da khiến da bị mất màu do tiếp xúc nhiều lần với các hợp chất hóa học cụ thể. Tình trạng này không gây hại về mặt thể chất, nhưng nó gây biến dạng. Các vùng da bị mất màu được mô tả với miếng dán Daytrana có đường kính lên đến 8 inch. Tình trạng này không được cho là có thể phục hồi được, có thể gây ra đau khổ về cảm xúc (Xem Ảnh).
Chúng tôi đã xem xét các trường hợp bệnh bạch cầu hóa học liên quan đến miếng dán Daytrana được báo cáo cho cơ sở dữ liệu Hệ thống Báo cáo Sự kiện Có hại của FDA (FAERS)và được mô tả trong các tài liệu y khoa. FAERS chỉ bao gồm các báo cáo được gửi cho FDA nên có thể có thêm các trường hợp khác mà chúng tôi không biết. FDA đã xác định 51 trường hợp FAERS từ tháng 4 năm 2006 đến tháng 12 năm 2014 và một trường hợp đã công bố nhưng không được ghi nhận trong FAERS. Thời gian khởi phát bệnh bạch cầu sau khi bắt đầu Daytrana dao động từ 2 tháng đến 4 năm. Tất cả các bệnh nhân đều mô tả giảm hoặc mất màu da. Trong hầu hết các trường hợp, sự mất màu da chỉ giới hạn ở những vùng xung quanh nơi miếng dán được xoay. Tuy nhiên, một số ít bệnh nhân cũng cho biết có sự thay đổi màu da trên các bộ phận của cơ thể nơi miếng dán không bao giờ được dán. Trong mọi trường hợp, màu da giảm là vĩnh viễn.
Chúng tôi kêu gọi bệnh nhân và các chuyên gia chăm sóc sức khỏe báo cáo các tác dụng phụ liên quan đến miếng dán Daytrana cho chương trình FDA MedWatch, sử dụng thông tin trong ô “Liên hệ với FDA” ở cuối trang.
Comments
Post a Comment