Thông tin liên lạc về An toàn Thuốc của FDA: Thay đổi quan trọng đối với nhãn bao bì đựng heparin để nêu rõ tổng nồng độ thuốc
Thông báo An toàn
[12-06-2012] Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) sẽ thông báo cho các chuyên gia chăm sóc sức khỏe, người chăm sóc và bệnh nhân về việc thay đổi bao bì và nhãn thùng đối với các sản phẩm heparin, là chất làm loãng máu ngăn ngừa sự hình thành các cục máu đông.
Sự thật về heparin |
|
Việc thay đổi nhãn này sẽ yêu cầu nhà sản xuất Heparin Lock Flush Solution, USP và Heparin Sodium Injection, USP phải ghi rõ độ bền của toàn bộ hộp đựng thuốc, kèm theo đó là lượng thuốc trong 1 mililit (mL). Những sửa đổi này sẽ loại bỏ nhu cầu của các chuyên gia chăm sóc sức khỏe để tính toán tổng lượng thuốc heparin trong một sản phẩm có chứa hơn 1 mL, do đó giảm nguy cơ tính toán sai có thể dẫn đến sai sót thuốc.
FDA ủng hộ đề xuất của Dược điển Hoa Kỳ (USP) * sửa đổi phần ghi nhãn trong sách chuyên khảo USP cho Heparin Lock Flush Solution, USP và Heparin Sodium Injection, USP để ghi rõ tổng nồng độ thuốc trên nhãn. Điều này sẽ đảm bảo rằng nhãn cho các sản phẩm heparin tuân thủ các yêu cầu chung của USP đối với tất cả các sản phẩm tiêm thể tích nhỏ, hiện đang hiển thị tổng hàm lượng thuốc.
Các chuyên gia chăm sóc sức khỏe, người chăm sóc và bệnh nhân nên lưu ý rằng sẽ có một giai đoạn chuyển tiếp trước và sau ngày triển khai chính thức vào ngày 1 tháng 5 năm 2013, trong đó cả nhãn hộp đựng heparin hiện tại và nhãn hộp đựng heparin sửa đổi sẽ có sẵn trong thị trường. Để giảm thiểu khả năng xảy ra lỗi thuốc, người dùng nên cân nhắc tách nguồn cung cấp heparin được dán nhãn “hiện tại” và “sửa đổi”, đồng thời sử dụng tất cả nguồn cung cấp của heparin “hiện tại” trước khi sử dụng các sản phẩm có nhãn hộp đựng “đã sửa đổi”.
* USP là một tổ chức phi lợi nhuận khoa học phát triển các tiêu chuẩn về nhận dạng, sức mạnh, chất lượng và độ tinh khiết của thuốc và thành phần thuốc được bán trên thị trường tại Hoa Kỳ. Các tiêu chuẩn này được xuất bản trong tài liệu chính thức của USP, Dược điển Hoa Kỳ và Danh mục thuốc quốc gia .
Nhãn Heparin Hiện tại và Đã được Sửa đổi
Nhãn Heparin hiện tại | Nhãn Heparin sửa đổi |
Việc sửa đổi đề xuất đối với các phần ghi nhãn trong các chuyên khảo về heparin sẽ yêu cầu các nhãn phải tuân thủ các tiêu chuẩn của USP đối với thuốc tiêm, cụ thể là phần Thuốc tiêm USP 35 -NF 30 Chương chung <1>.
Các định dạng sau đây được FDA cho là có thể chấp nhận được đối với các lọ và ống tiêm heparin chứa hơn 1 mL:
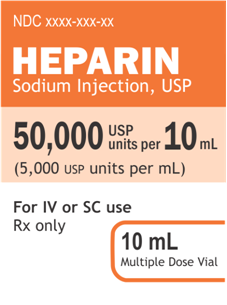
Cường độ trên tổng thể tích phải là biểu thức chính và nổi bật trên bảng hiển thị chính của nhãn, tiếp theo là cường độ trên mỗi mL được đặt trong dấu ngoặc đơn.
Ví dụ 1:
50.000 đơn vị USP trên 10 mL
(5.000 đơn vị USP trên mL)Ví dụ 2:
50.000 đơn vị USP / 10 mL
(5.000 đơn vị USP / mL)
Định dạng sau đây được chấp nhận cho các nội dung dưới 1 mL:
Độ mạnh trên mỗi phần của mL phải là biểu thức duy nhất của độ mạnh.
100 đơn vị USP / 0,5 mLCường độ trên mỗi mL đơn lẻ phải được biểu thị bằng mg / mL, không phải mg / 1 mL.
5.000 USP đơn vị / mL
Thông tin bổ sung cho bệnh nhân và người chăm sóc
- Luôn yêu cầu chuyên gia chăm sóc sức khỏe của bạn xem nhãn trên hộp đựng heparin và kiểm tra liều lượng và thể tích sử dụng.
- Liên hệ với chuyên gia chăm sóc sức khỏe của bạn nếu bạn có bất kỳ câu hỏi hoặc thắc mắc nào về heparin.
- Báo cáo lỗi thuốc hoặc tác dụng phụ do sử dụng heparin cho chương trình MedWatch của FDA, sử dụng thông tin trong hộp "Liên hệ với FDA" ở cuối trang này.
Thông tin bổ sung cho các chuyên gia chăm sóc sức khỏe, bệnh viện và hiệu thuốc
- Để giảm thiểu khả năng xảy ra sai sót thuốc, các bệnh viện và nhà thuốc có thể muốn xem xét tách nguồn cung cấp heparin được dán nhãn “hiện tại” và “sửa đổi” và sử dụng hết nguồn cung cấp heparin “hiện tại” trước khi chuyển sang các sản phẩm có nhãn “sửa đổi”.
- Luôn xem nhãn trên lọ heparin đang được phân phối và tư vấn cho bệnh nhân hoặc người chăm sóc về cách sử dụng đúng liều lượng.
- Báo cáo lỗi thuốc hoặc các sự kiện bất lợi liên quan đến heparin cho chương trình MedWatch của FDA, sử dụng thông tin trong hộp "Liên hệ với FDA" ở cuối trang này.
Thông tin cơ bản bổ sung
Vào năm 2003, Ủy ban Chuyên gia về Sử dụng Thuốc An toàn của Dược điển Hoa Kỳ (USP) đã biết về các lỗi thuốc liên quan đến việc thể hiện sức mạnh trong ghi nhãn cho tất cả các sản phẩm tiêm. Các vật chứa được dán nhãn nồng độ trên mỗi mL thường bị hiểu nhầm là tổng hàm lượng thuốc, điều này có thể dẫn đến sai số về liều lượng gây hậu quả nghiêm trọng cho bệnh nhân. Để giải quyết vấn đề an toàn này, Ủy ban chuyên gia công nghiệp ― Sản phẩm đường tiêm của USP đã phê duyệt mục “Sức mạnh và tổng thể tích cho các sản phẩm thuốc tiêm một lần và nhiều liều” trong Chương chung của USP <1> Thuốc tiêm vào năm 2007, và văn bản đã trở thành chính thức vào ngày 1 tháng 2 năm 2009. Chương chung <1> yêu cầu cường độ trên tổng khối lượng phải là biểu hiện chính và nổi bật của cường độ trên bảng hiển thị chính của nhãn, theo sau gần bằng độ mạnh trên mỗi mL được đặt trong dấu ngoặc đơn. Các nhãn hộp đựng đã được thay đổi để ghi rõ cường độ trên tổng thể tích đã không có lỗi thuốc nào được báo cáo.
Kể từ năm 2009, những lo ngại đã nảy sinh về mâu thuẫn trong yêu cầu ghi nhãn giữa các chuyên khảo về Thuốc tiêm Heparin Sodium và Heparin Lock Flush Solution và phần Tiêm chung của Chương <1> về “Sức mạnh và Tổng thể tích cho các sản phẩm thuốc tiêm một lần và nhiều liều”. Yêu cầu ghi nhãn trong các chuyên khảo về heparin hiện tại quy định rằng nhãn chỉ được phản ánh nồng độ trên mỗi mL, ngoại trừ nó cũng cho phép các lọ đơn liều được dán nhãn bổ sung để chỉ ra tổng hàm lượng thuốc. Để giải quyết xung đột này, USP đã đề xuất sửa đổi phần ghi nhãn của các chuyên khảo về heparin để đảm bảo rằng các nhãn hộp đựng heparin tuân thủ phần Tiêm tiêm <1> Chương chung của USP.
Bản sửa đổi được đề xuất đối với các phần ghi nhãn trong các chuyên khảo về heparin sẽ yêu cầu các nhãn hộp phải tuân theo USP 35 -NF 30 Chương chung <1> Phần tiêm có nội dung:
“[T] cường độ trên mỗi tổng thể tích phải là biểu thức chính và nổi bật trên bảng hiển thị chính của nhãn, theo sau là cường độ trên mỗi mL được đặt trong dấu ngoặc đơn. Đối với các vật chứa có thể tích nhỏ hơn 1 mL, cường độ trên mỗi phần của mL phải là biểu thức duy nhất của độ mạnh. Cường độ trên mỗi mL đơn lẻ phải được biểu thị bằng mg / mL, không phải mg / 1 mL. ”
Ngày triển khai chính thức cho USP Heparin Lock Flush Solution và USP Heparin Sodium Injection là ngày 1 tháng 5 năm 2013. Các nhà sản xuất dự kiến sẽ sửa đổi nhãn heparin của họ cho phù hợp vào thời điểm đó. Một giai đoạn chuyển tiếp sẽ xảy ra trong đó cả nhãn hộp đựng heparin hiện tại và nhãn hộp đựng heparin đã sửa đổi sẽ xuất hiện trên thị trường.

Comments
Post a Comment