Thông tin liên lạc về An toàn Thuốc của FDA: Những thay đổi quan trọng về an toàn đối với thuốc cúm Tamiflu (oseltamivir phosphate) để pha hỗn dịch uống
Thông báo An toàn
[7-11-2011] Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) thông báo cho công chúng về những thay đổi quan trọng về an toàn sản phẩm đối với thuốc cúm Tamiflu (oseltamivir phosphate) dạng hỗn dịch uống. Những thay đổi này đang được thực hiện để giảm khả năng kê đơn và nhầm lẫn liều lượng có thể dẫn đến sai sót thuốc. FDA đã làm việc với nhà sản xuất, Genentech (một phần của Roche Group), để thực hiện những thay đổi này.
Những thay đổi đối với hỗn dịch uống Tamiflu và nhãn sản phẩm bao gồm:
Sự thật về Tamiflu
- Trong một nhóm thuốc được gọi là chất ức chế neuraminidase. Những loại thuốc này hoạt động bằng cách ngăn chặn sự lây lan của vi-rút cúm (cúm) trong cơ thể.
- Giúp rút ngắn thời gian bạn có các triệu chứng cúm như nghẹt mũi hoặc sổ mũi, đau họng, ho, đau nhức cơ hoặc khớp, mệt mỏi, nhức đầu, sốt và ớn lạnh
- Được sử dụng để điều trị một số loại bệnh cúm ở người lớn và trẻ em (trên 1 tuổi) đã có các triệu chứng không quá 2 ngày. Nó cũng được sử dụng để ngăn ngừa một số loại bệnh cúm ở người lớn và trẻ em (trên 1 tuổi) khi họ ở với người bị cúm hoặc khi có dịch cúm. 1
- Sự thay đổi nồng độ của Tamiflu từ 12 mg / mL đến 6 mg / mL. Nồng độ Tamiflu thấp hơn sẽ ít bị sủi bọt khi lắc, giúp đảm bảo phép đo chính xác. Nồng độ 12 mg / mL sẽ không còn được bán trên thị trường sau khi hết nguồn cung cấp hiện tại.
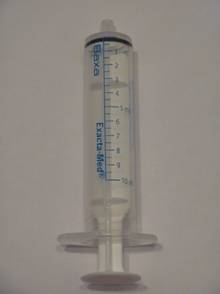
- Sự thay đổi số đo của dụng cụ định lượng uống ( đồ thị) từ miligam (mg = trọng lượng) sang mililit (mL = thể tích).
- Một thay đổi trong bảng định lượng đối với Tamiflu để bao gồm cột cho thể tích (mL) dựa trên nồng độ 6 mg / mL mới. ( Bảng 1 )
Đã sửa đổi nhãn thùng và bao bì carton ( đồ họa ).
Hướng dẫn pha chế được sửa đổi dành cho các hiệu thuốc để điều chế hỗn dịch uống 6 mg / mL từ viên nang Tamiflu trong trường hợp khẩn cấp chỉ khi Tamiflu được sản xuất thương mại cho hỗn dịch uống không có sẵn.
Genentech, nhà sản xuất Tamiflu cho hỗn dịch uống, có kế hoạch bắt đầu phân phối sản phẩm 6 mg / mL mới vào tháng 7 năm 2011. Công ty đã thiết lập Chương trình Mua lại tự nguyện cho người mua sỉ, nhà phân phối và hiệu thuốc để loại bỏ sản phẩm 12 mg / mL khỏi thị trường.
Không có vấn đề chất lượng nào với sản phẩm 12 mg / mL — sản phẩm vẫn có thể sử dụng được cho đến ngày hết hạn. Tuy nhiên, FDA khuyến khích tham gia vào Chương trình Lấy lại hàng để hạn chế khả năng nhầm lẫn sản phẩm.
Sản phẩm 12 mg / mL sẽ vẫn còn trên thị trường và trong kho dự trữ của tiểu bang hoặc quốc gia cho đến khi nguồn cung cấp hiện tại hết hạn. Do đó, các chuyên gia chăm sóc sức khỏe cần lưu ý rằng bệnh nhân có thể nhận được một trong hai nồng độ (6 mg / mL hoặc 12 mg / mL) từ nhà thuốc của họ trong mùa cúm tiếp theo (2011-2012). Cần thực hiện các bước để tránh khả năng xảy ra lỗi thuốc do nhầm lẫn giữa hai nồng độ (xem phần Thông tin bổ sung bên dưới).
Để biết thông tin cơ bản đầy đủ về Tamiflu, vui lòng xem Thông tin về Tamiflu (oseltamivir phosphate) .
Thông tin bổ sung cho bệnh nhân
- Nồng độ của Tamiflu cho hỗn dịch uống đang thay đổi và bạn có thể nhận được một trong hai nồng độ tại hiệu thuốc của mình trong mùa cúm tiếp theo.
- Nhãn Tamiflu mới dành cho hộp đựng hỗn dịch uống và bao bì carton trông khác với những gì bạn có thể đã dùng trước đây.
- Thiết bị định lượng uống mới khác và thể tích (mL) liều của bạn có thể khác với các đơn thuốc trước đây.
- Kiểm tra với chuyên gia chăm sóc sức khỏe nếu bạn có bất kỳ câu hỏi nào về hướng dẫn dùng thuốc, cách đo liều bằng thiết bị định lượng mới hoặc về nồng độ của Tamiflu cho hỗn dịch uống mà bạn có.
- Báo cáo bất kỳ tác dụng phụ nào bạn gặp phải hoặc lỗi thuốc cho chuyên gia chăm sóc sức khỏe của bạn và chương trình FDA MedWatch bằng cách sử dụng thông tin trong hộp “Liên hệ với chúng tôi” ở cuối trang.
Thông tin bổ sung cho các chuyên gia chăm sóc sức khỏe
- Người kê đơn nên bao gồm nồng độ mới (6 mg / mL) và liều lượng tính bằng mililit trên tất cả các đơn thuốc Tamiflu cho hỗn dịch uống. Biểu đồ liều lượng sửa đổi trong Bảng 1 cung cấp liều lượng tính bằng mililit, và được bao gồm trong nhãn chuyên nghiệp đã sửa đổi.
- Người kê đơn cần lưu ý rằng viên nang Tamiflu dành cho trẻ em (30 mg và 45 mg) luôn sẵn có và không thay đổi. Những viên nang này có thể được kê đơn cho những bệnh nhi có thể nuốt viên nang. Đối với những bệnh nhân không thể nuốt viên nang, có thể mở những viên nang này ra và có thể trộn nội dung viên nang với thức ăn có hương vị (chẳng hạn như xi-rô sô-cô-la hoặc lớp phủ caramel).
- Sản phẩm 6 mg / mL mới chứa thiết bị định lượng uống được chia độ bằng mL, trong khi sản phẩm cũ 12 mg / mL chứa thiết bị định lượng đường uống với vạch liều tính bằng mg.
- Có thể bệnh nhân có thể tập trung tại nhà thuốc trong mùa cúm 2011-2012; bệnh nhân nên được giáo dục về khả năng này để tránh sai sót khi dùng thuốc.
- Hai phiên bản của nhãn chuyên nghiệp có thể được lưu hành trong mùa cúm tiếp theo (2011-12) và chứa các hướng dẫn về liều lượng và cách pha chế khác nhau cho hỗn dịch uống.
- Báo cáo các sự kiện bất lợi hoặc lỗi thuốc liên quan đến Tamiflu cho chương trình FDA MedWatch, sử dụng thông tin trong hộp “Liên hệ với chúng tôi” ở cuối trang.
Thông tin bổ sung cho các hiệu thuốc
- Biện pháp quan trọng nhất mà hiệu thuốc có thể thực hiện là tham gia vào Chương trình Mua lại và thay thế nồng độ 12 mg / mL của Tamiflu cho hỗn dịch uống bằng nồng độ 6 mg / mL mới.
- Các hiệu thuốc nên liên hệ với nhà phân phối của họ nếu họ có Tamiflu 12 mg / mL dạng hỗn dịch uống chưa sử dụng / chưa phân phối để xác định xem sản phẩm có thể được trả lại thông qua Chương trình Mang về trước ngày 31 tháng 8 năm 2011 hay không.
- Dược sĩ nên xác minh rằng mỗi đơn thuốc Tamiflu để pha hỗn dịch uống có chứa nồng độ (mg / mL) và liều lượng (mL). Nếu không ghi rõ nồng độ và liều lượng thì dược sĩ cần làm rõ đơn thuốc với người kê đơn.
- Dược sĩ phải đảm bảo rằng các đơn vị đo cho hướng dẫn dùng thuốc trên chai phù hợp với dụng cụ định lượng đường uống được cung cấp (ví dụ: đối với sản phẩm 6 mg / mL mới, đơn vị đo cho cả thuốc và thiết bị phải tính bằng mililit. ).
- Dược sĩ phải đảm bảo cung cấp đúng liều lượng, hướng dẫn dùng thuốc và dụng cụ định lượng đường uống cho bệnh nhân và phù hợp với nồng độ của Tamiflu cho hỗn dịch uống (6 mg / mL hoặc 12 mg / mL) mà bệnh nhân sẽ nhận được.
FDA đã làm việc với Genentech để thực hiện những thay đổi quan trọng về tính an toàn của sản phẩm đối với Tamiflu dành cho sản phẩm hỗn dịch uống và để giải quyết các vấn đề dễ xảy ra lỗi thuốc mà FDA đã xác định và thông báo trước đây.
FDA đã ban hành một Cảnh báo Sức khỏe Cộng đồngvào tháng 9 năm 2009 về khả năng xảy ra lỗi thuốc với việc sử dụng Tamiflu cho hỗn dịch uống. Cơ quan này đã nhận được báo cáo về các lỗi trong đó hướng dẫn dùng thuốc cho bệnh nhân không khớp với dụng cụ phân phối liều lượng. Ngoài ra, Tamiflu thương mại cho nồng độ hỗn dịch uống (12 mg / mL) khác với nồng độ của hỗn dịch hỗn hợp để sử dụng khẩn cấp (15 mg / mL khi được làm từ viên nang Tamiflu 75 mg), điều này cũng có thể góp phần gây nhầm lẫn và thuốc các lỗi.
FDA đã ban hành một Tư vấn Y tế Công cộngvào tháng 12 năm 2009 về sự sẵn có của Tamiflu cho hỗn dịch uống trong tình trạng khan hiếm sản phẩm tổng thể. Bởi vì nồng độ của Tamiflu trên thị trường cho hỗn dịch uống đã thay đổi thành 6 mg / mL, các hướng dẫn kết hợp khẩn cấp mà FDA cung cấp vào năm 2009 hiện đang được cập nhật để đưa ra nồng độ cuối cùng là 6 mg / mL. Sự thay đổi này sẽ điều chỉnh nồng độ cuối cùng của hỗn hợp khẩn cấp với nồng độ hỗn dịch uống mới được bán trên thị trường là 6 mg / mL, có thể làm giảm khả năng xảy ra sai sót trong kê đơn và dùng thuốc. FDA nhắc lại rằng hỗn dịch hỗn hợp này không nên được sử dụng đơn thuần để thuận tiện, hoặc khi có sẵn Tamiflu được FDA chấp thuận cho hỗn dịch uống.
Người giới thiệu
- Thư viện Y khoa Quốc gia Hoa Kỳ. Viện Y tế Quốc gia. Chuyên khảo về Thuốc-Oseltamivir. Có tại http://www.nlm.nih.gov/medlineplus/druginfo/meds/a699040.html . Truy cập ngày 15 tháng 4 năm 2011.
Biểu đồ Liều lượng Tamiflu Mới (Bảng 1)
Bảng 1. Điều trị và Dự phòng Liều lượng Tamiflu Uống cho Bệnh Cúm
Đối với bệnh nhân từ 1 tuổi trở lên dựa trên trọng lượng cơ thể
Trọng lượng | Trọng lượng | | | Thể tích của Liều lượng * | Số lượng | Số |
|---|---|---|---|---|---|---|
15 kg trở xuống | 33 lbs trở xuống | 30 mg x 2 lần / ngày | 30 mg một lần mỗi ngày | 5 mL | 1 chai | 10 viên nang 30 mg |
16 kg đến 23 kg | 34 lbs đến 51 lbs | 45 mg x 2 lần / ngày | 45 mg x 1 lần / ngày | 7,5 mL | 2 chai | 10 viên nang 45 mg |
24 kg đến 40 kg | 52 lbs đến 88 lbs | 60 mg x 2 lần / ngày | 60 mg một lần mỗi ngày | 10 mL | 2 chai | 20 viên nang 30 mg |
41 kg trở lên | 89 lbs trở lên | 75 mg x 2 lần / ngày | 75 mg một lần mỗi ngày | 12,5 mL † | 3 chai | 10 viên nang 75 mg |
* Một hộp định lượng uống 10 mL được cung cấp cùng với hỗn dịch uống. Trong trường hợp bộ phân phối được cung cấp bị mất hoặc bị hỏng, một bộ phân phối định lượng khác có thể được sử dụng để phân phối khối lượng.
† Phân phối Tamiflu này cho liều hỗn dịch uống yêu cầu sử dụng 10 mL sau đó là 2,5 mL khác.
Thiết bị phân phối / ống tiêm mới bằng miệng (10 mL) với các vạch dấu tính bằng mL
Ảnh nhãn hộp đựng mới (6mg / mL)
Ảnh nhãn hộp cũ (12 mg / mL)


Comments
Post a Comment